Новые аспекты механизма электрофильного ароматического замещения: квантово-химическая модель реакции нитрования
Жидкая фаза
Расчеты, выполненные методом SM2.1, дают результаты, во многом схожие с вышеприведенными, полученными в рамках газофазного. Существенное отличие заключается в том, что сольватации/десольватация реагентов в ходе реакции приводит к классическому профилю реакции с ярко выраженным активационным барьером. Появление барьера связано с делокализацией положительного заряда в ПС и, как следствие, десольватации NO2+ катиона. Никакого предреакционного комплекса в SM2.1 расчетах не обнаруживается, что означает, что никакого особого сродства между NO2+ и ароматикой нет, лишь эффекты сольватации. В жидкой фазе σ-complex становится эндотермической нестабильной структурой, в соответствии с химическими представлениями. Его распад с выбросом H+ представляет собой экзотермический процесс с едва заметным барьером активации.
σ -Комплекс
В сравнении с результатами газофазных расчетов, σ-комплекс в жидкой фазе характеризуется бóльшей деформацией и поляризацией C-H связи. Она удлиняется на 15%, заряд H-атома 0.43, а частота валентного колебания C-H меняется до 2200 см −1 (от обычных 3100 см −1). Реакции с малоактивным субстратом с поздним ПС не имеют σ-комплекса вообще: протон покидает молекулу синхронно с присоединением NO2+.
ПС и координата реакции
В области первого ПС координата реакции опять представляет собой трансляционное движение NO2-группы. На второй стадии реакции, при выбросе протона, координата реакции есть комплексное движение, состоящее из валентных и деформационных колебаний связи C-H. Вторая стадия протекает практически без барьера, 1.5 ккал/моль для бензола (см. Таблицу IV). Двигаясь от ПС вдоль вектора градиента энергии можно проследить характер изменения энергии и зарядов в процессе реакции (Рис. 4 и 5). Некоторые параметры стационарных точек на пути реакции представлены в Таблице IV.
C1-N | ∠C4C1N | C1-H | ∠C4C1H | qNO2 | qN | qH | qC6H5 | ΔΔHf | |
|---|---|---|---|---|---|---|---|---|---|
| Изолированные реагенты | ∞ | – | 1.101 | 180 | 1.000 | 0.778 | 0.148 | −0.148 | 0 |
| ПС1 | 1.977 | 122 | 1.124 | 144 | 0.445 | 0.644 | 0.229 | 0.326 | 42.7 |
| σ-комплекс | 1.537 | 148 | 1.277 | 103 | −0.159 | 0.512 | 0.432 | 0.727 | 22.9 |
| ПС2 | 1.519 | 147 | 1.453 | 110 | −0.186 | 0.523 | 0.656 | 0.531 | 24.4 |
| Продукт | 1.484 | 180 | ∞ | – | −0.221 | 0.519 | 1.000 | 0.221 | −71.7 |
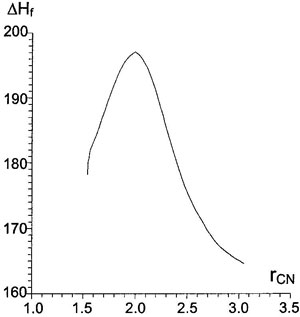 Figure 4. Зависимость энтальпии образования супермолекулы (ккал/моль) от расстояния
Figure 4. Зависимость энтальпии образования супермолекулы (ккал/моль) от расстояния C-N (Å) на первой стадии реакции (образование σ-комплекса), AM1/SM2.1.
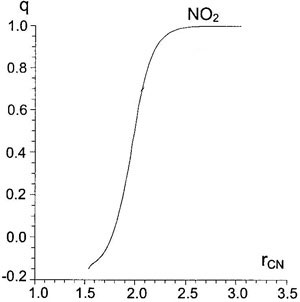 Figure 5. Зависимость заряда
Figure 5. Зависимость заряда NO2-группы от расстояния C-N (Å) на первой стадии реакции, AM1/SM2.1.
