Реакционная способность в реакциях радикального присоединения к ненасыщенным соединениям
Рассмотрение реакции с помощью теории ВМО
Теория ВМО по-прежнему является главным инструментом при рассмотрении реакционной способности различных химических реакций. Наш случай хорош тем, что можно ограничиться π-приближением.
Энергия межмолекулярного взаимодействия, исторически также именуемая энергией переноса заряда (CT, charge transfer energy), в теории ВМО дается известным выражением:
(1)
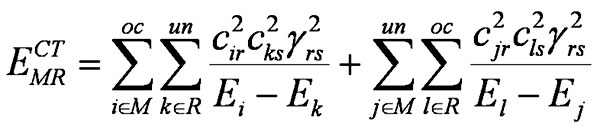
где суммирование выполняется по набору спин-орбиталей, а γ – резонансный интеграл на атомных орбиталях реакционных центров r и s.
Используя ОХФ π-орбитали изолированных реагентов мы рассчитали ECT для всех рассматриваемых реакционных серий (см., например, Таблицы V и VI). Рисунок 4 демонстрирует существование некоторого соответствия между ECT и энергиями активации соответствующих реакций. Присоединение к замещенной позиции двойной связи (α-присоединение) дает менее удовлетворительную зависимость, что, очевидно, связано с бóльшим стерическим эффектом (энергией деформации реакционного центра).
Итак, будем использовать ECT в качестве второго фактора реакционной способности. Есть лишь одно неудобство: это необычный ИРС (приписывемый конкретной молекуле), а величина, сложным образом зависящая от электронного строения МО обоих реагентов (см. выражение 1). Поэтому неудивительно, что при использовании ВМО многие стремятся "урезать" набор МО реагентов, оставив только высшую занятую (HOMO) и низшую свободную (LUMO) молекулярные орбитали для того, чтобы избежать суммирования в выражении (1); этот подход известен как приближение граничных орбиталей (ГО).
| Мономер | β-атака | α-атака | ||||||
|---|---|---|---|---|---|---|---|---|
| Ea | ECT | N | G | Ea | ECT | N | G | |
| Ea, kcal/mol; ECT, (γ2/эВ); N и G, эВ. | ||||||||
| Eth | 26.4 | −0.286 | 1.304 | 14.1 | ||||
| Prop | 25.8 | −0.294 | 1.147 | 13.7 | 31.0 | −0.285 | 1.460 | 14.2 |
| AN | 26.0 | −0.287 | −1.740 | 14.1 | 30.3 | −0.271 | 0.284 | 14.8 |
| MA | 26.8 | −0.284 | −2.187 | 14.4 | 31.3 | −0.270 | 0.726 | 14.8 |
| VA | 23.9 | −0.307 | 2.011 | 13.3 | 26.8 | −0.278 | 0.738 | 14.4 |
| VCl | 26.5 | −0.284 | −0.355 | 14.1 | 30.2 | −0.273 | 0.233 | 14.7 |
| VCl2 | 25.7 | −0.289 | −1.625 | 14.0 | 32.0 | −0.266 | −0.459 | 15.1 |
| St | 23.0 | −0.311 | 1.371 | 13.0 | ||||
| ViNaph | 22.7 | −0.313 | 1.379 | 12.9 | ||||
| 2ViPy | 23.3 | −0.303 | 0.788 | 13.3 | ||||
| 4ViPy | 23.4 | −0.299 | 0.125 | 13.4 | ||||
| Bu2ene | 22.6 | −0.310 | 1.395 | 13.1 | ||||
| Hex3ene | 21.8 | −0.315 | 1.400 | 12.9 | ||||
| Мономер | β-атака | α- атака | ||||||
|---|---|---|---|---|---|---|---|---|
| Ea | ECT | N | G | Ea | ECT | N | G | |
| Ea, kcal/mol; ECT, (γ2/эВ); N и G, эВ. | ||||||||
| Eth | 13.9 | −0.349 | −0.735 | 11.5 | ||||
| Prop | 13.6 | −0.359 | −0.960 | 11.2 | 18.1 | −0.348 | −0.675 | 11.5 |
| St | 11.4 | −0.378 | −1.054 | 10.7 | −0.344 | −0.766 | 11.7 | |
| AN | 13.0 | −0.391 | −3.405 | 11.3 | 17.0 | −0.355 | −1.714 | 11.5 |
| MA | 13.4 | −0.388 | −3.738 | 11.5 | 18.0 | −0.349 | −1.342 | 11.6 |
| VA | 12.1 | −0.370 | −0.385 | 10.8 | 16.7 | −0.346 | −1.353 | 11.7 |
| VCl | 13.3 | −0.369 | −2.216 | 11.3 | 16.9 | −0.354 | −1.716 | 11.5 |
| VCl2 | 12.6 | −0.396 | −3.343 | 11.1 | 19.6 | −0.363 | −2.394 | 11.5 |
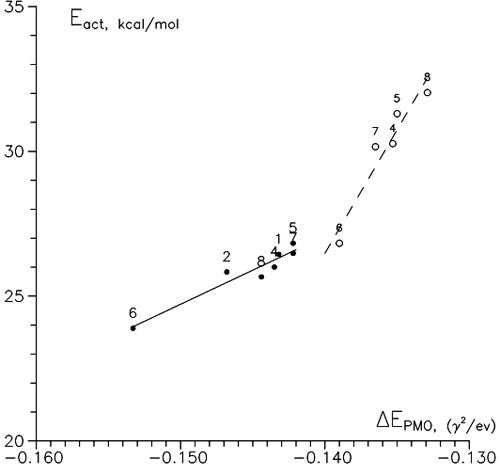 Рисунок 4. зависимость между энергиями активации и энергиями переноса заряда метода ВМО,
Рисунок 4. зависимость между энергиями активации и энергиями переноса заряда метода ВМО, HOO присоединение. • – β-атака; ○ – α-атака.
